Dra. Sophia Lozano, Md
Médico Oncólogo – Hospital Regional Docente (Cajamarca)
El cáncer de ovario es a nivel mundial la principal causa de muerte entre todos los cánceres ginecológicos, y la quinta causa de muerte en mujeres. La mayoría de las pacientes son diagnosticadas en etapas avanzadas de la enfermedad (estadios III y IV) (1,2). Europa registra más de 65 mil casos diagnosticados y más de 42 mil fallecimientos debido a esta enfermedad. Más del 90% de los tumores malignos de ovario se originan en el epitelio, lo que se conoce como cáncer epitelial de ovario (COE) el subtipo más frecuente dentro de este grupo es el carcinoma seroso de alto grado (HGSC) (1). El tratamiento estándar para este tipo de cáncer incluye cirugía y quimioterapia basada en platino, sin embargo, en la última década, tanto el Bevacizumab (un agente antiangiogénico) como los inhibidores de la poli (ADP-ribosa) polimerasa (PARP) han ganado relevancia en el tratamiento de esta neoplasia. A pesar de estos avances, se ha observado que existe una alta tasa de recurrencia después del tratamiento inicial, disminuyendo las posibilidades de curación. Por lo tanto, en este momento, adquiere una importancia crítica, las nuevas modalidades de tratamiento basadas en una mejor comprensión de la biología molecular de la enfermedad (2).
En el presente año, se han dado a conocer avances significativos en el tratamiento del cáncer de ovario durante el ASCO Annual Meeting 2023.
En primer lugar, se presenta el análisis interino del estudio de fase 3 DUO-O, un ensayo aleatorizado, doble ciego y multicéntrico, dirigido por el Dr. Philipp Harter y su equipo, dicho estudio evalúa la eficacia de Durvalumab en combinación con quimioterapia estándar basada en platino (Carboplatino/Paclitaxel) y Bevacizumab, seguido por mantenimiento con Durvalumab, Bevacizumab y Olaparib. Este estudio se llevó a cabo en pacientes con cáncer de ovario avanzado recién diagnosticado y que no presentaban mutaciones en los genes BRCA 1/2 (non-tBRCAm).
Los resultados revelaron que los pacientes que recibieron el tratamiento del brazo 3 (quimioterapia + Bevacizumab + Durvalumab, seguido de mantenimiento con Bevacizumab + Durvalumab + Olaparib) experimentaron una mayor sobrevida libre de progresión (PFS), con una mediana de 37,3 meses, en comparación con los 23 meses del brazo 1 (quimioterapia + Bevacizumab, seguido de mantenimiento con Bevacizumab) en pacientes con deficiencia de la recombinación homóloga (HRD (+)). En la población de intención de tratar (ITT), la PFS fue de 24,2 meses en el brazo 3, en contraste con los 19,3 meses en el brazo 1. A los 18 meses, el 84% de los participantes con HRD (+) en el brazo 3 no había experimentado progresión, en comparación con el 69% en el brazo 1. En la población ITT a los 18 meses, el 71% en el brazo 3 no había experimentado progresión, frente al 55% en el brazo 1. Los investigadores continúan observando a estos participantes para determinar si el tratamiento del brazo 2 (quimioterapia + Bevacizumab + Durvalumab, seguido de mantenimiento con Bevacizumab + Durvalumab) resulta más beneficioso que el tratamiento estándar actual. En términos de efectos secundarios, los porcentajes de eventos graves fueron comparables entre los tres brazos del estudio, con un 34% en el brazo 1, 43% en el brazo 2 y 39% en el brazo 3 (3,4).

Fuente: American Society of Clinical Oncology
Además, tenemos el estudio de fase 3 MIRASOL (GOG 3045/ENGOT-ov55), presentado por la Dra. Kathleen Moore y su equipo, en el que se evaluó el efecto de Mirvetuximab Soravtansine (MIRV) en comparación con la quimioterapia elegida por el investigador, en cánceres epiteliales de ovario, primarios peritoneales o de trompa de Falopio, en estadios avanzados, de alto grado y resistentes al platino, pero con una alta expresión del receptor de folato alfa. Los resultados indicaron que Mivertuximab soravtansine, un anticuerpo conjugado con un inhibidor de microtúbulos, mejoró de manera significativa la sobrevida libre de progresión y la sobrevida global en pacientes con neoplasias resistentes al platino y con una alta expresión del receptor folato alfa (FRa) (5).
Con una mediana de seguimiento de 13,1 meses, se observó que el 14% de los participantes recibieron una línea de tratamiento previa, el 39% recibió dos líneas y el 47% había recibido tres líneas previas de tratamiento. De los participantes, el 62% recibió Bevacizumab y el 55% recibió terapia con inhibidores de PARP (6). En aquellos que previamente habían sido tratados con Bevacizumab, la sobrevida libre de progresión mejoró en un 36%, y la sobrevida global fue un 26% mayor para aquellos que recibieron MIRV en comparación con el tratamiento estándar seleccionado por el médico (5).
En cuanto al perfil de eventos adversos relacionados con MIRV, se observaron predominantemente eventos oculares de bajo grado (todos los grados 56% vs. 9%, grado 3+ 14% vs. 0%) y eventos gastrointestinales (todos los grados 70% vs. 66%, grado 3+ 13% vs. 15%). Las tasas de interrupciones debido a eventos adversos emergentes del tratamiento (TEAE) fueron del 9% en comparación con el 16% (6). Además, un 14% de los participantes continuaron con el fármaco de estudio, en contraste con el 3% que recibieron quimioterapia estándar (5).
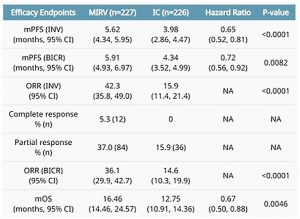
Fuente: American Society of Clinical Oncology
Por último, en cuanto al estudio fase 2 ENGOT-ov60/GOG-3052/RAMP 201, se presentó por la Dra. Susana Banerjee y su equipo, y abordó el uso de Avutometinib (VS-6766) ± Defactinib en el tratamiento del cáncer de ovario seroso de bajo grado recurrente (COSBG). Este estudio se centra en la vía RAS/MAPK, la cual impulsa el crecimiento de esta neoplasia. Avutometinib es una molécula pequeña que inhibe la vía RAF/MEK, la activación de la cinasa de adhesión focal (FAK) es un mecanismo de resistencia a la inhibición de RAF/MEK, y Dafactinib ejerce un efecto inhibitorio sobre FAK, lo que muestra actividad antitumoral sinérgica con Avutometinib, como se observó en modelos preclínicos (7).
En relación con los resultados, los pacientes alcanzaron tasas de respuesta objetiva (ORR) del 10% con la monoterapia de Avutometinib y del 45% con la combinación, dentro de los grupos con mutación KRAS y sin mutación KRAS que recibieron monoterapia, se observaron ORR del 13% y 6%, respectivamente. Las tasas de control de la enfermedad (DCR) fueron del 93% y 88%. En aquellos que recibieron la combinación, las ORR fueron del 60% y 29%, respectivamente. Las DCR fueron del 100% y 79%, respectivamente (8). Se observó enfermedad estable (SD) en el 80% de los pacientes en el grupo de Avutometinib con mutaciones KRAS y en el 81% de los pacientes con mutaciones KRAS ausentes. En el caso de la combinación, se informó SD en el 40% y 50% de los pacientes con mutaciones KRAS y KRAS ausentes.
En cuanto a la seguridad, en el grupo de la combinación, el 12,3% de los pacientes interrumpieron Avutometinib o Defactinib debido a eventos adversos de grado 1 o superior, y el 4,9% debido a niveles elevados de creatina fosfoquinasa (CPK) en sangre. Los eventos adversos relacionados con el tratamiento (TRAE) más comunes en todos los pacientes, tanto en el grupo de monoterapia como en el de combinación, fueron de cualquier grado: náuseas (55,7% frente a 61,7%), diarrea (71,4% frente a 49,4%), elevación de CPK en sangre (50,0% frente a 48,1%), edema periférico (48,6% frente a 42,0%), vómitos (40,0% frente a 37,0%) y visión borrosa (41,4% frente a 35,8%), respectivamente. La mayoría de estos eventos fueron de grado 1/2 en términos de gravedad (8). Los TRAE de grado 3 o superior incluyeron elevación de CPK en sangre (22,9% frente a 18,5%), anemia (11,4% frente a 3,7%), dermatitis acneiforme (8,6% frente a 2,5%), vómitos (5,7% frente a 0%), náuseas (4,3% frente a 0%) y diarrea (4,3% frente a 3,7%), entre otros, en los brazos de monoterapia y combinación, respectivamente (8).
Bibliografía
- Colombo N, Sessa C, Du Bois A, Ledermann J, McCluggage WG, McNeish I, et al. ESMO– ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. Ann Oncol. mayo de 2019;30(5):672-705.
- Arora T, Mullangi S, Lekkala Ovarian Cancer. En: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [citado 13 de agosto de 2023]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK567760/
- Harter P, Trillsch F, Okamoto A, Reuss A, Kim JW, Rubio-Pérez MJ, et al. Durvalumab with paclitaxel/carboplatin (PC) and bevacizumab (bev), followed by maintenance durvalumab, bev, and olaparib in patients (pts) with newly diagnosed advanced ovarian cancer (AOC) without a tumor BRCA1/2 mutation (non-tBRCAm): Results from the randomized, placebo (pbo)-controlled phase III DUO-O trial. J Clin Oncol. 10 de junio de 2023;41(17_suppl):LBA5506-LBA5506.
- Net [Internet]. 2023 [citado 13 de agosto de 2023]. ASCO Annual Meeting 2023: Adding Durvalumab and Olaparib to Treatment Delays Growth of Ovarian Cancer..Disponible en: https://www.cancer.net/blog/2023-06/asco-annual-meeting-2023-adding- durvalumab-and-olaparib-treatment-delays-growth-ovarian-cancer
- Staff TAP. Mirvetuximab Soravtansine Improves Survival in Patients With Recurrent Ovarian Cancer – The ASCO Post [Internet]. [citado 13 de agosto de 2023]. Disponible en: https://ascopost.com/news/june-2023/mirvetuximab-soravtansine-improves-survival-in- patients-with-recurrent-ovarian-cancer/
- Moore KN, Angelergues A, Konecny GE, Banerjee SN, Pignata S, Colombo N, et al. Phase III MIRASOL (GOG 3045/ENGOT-ov55) study: Initial report of mirvetuximab soravtansine investigator’s choice of chemotherapy in platinum-resistant, advanced high-grade epithelial ovarian, primary peritoneal, or fallopian tube cancers with high folate receptor-alpha expression. J Clin Oncol. 10 de junio de 2023;41(17_suppl):LBA5507-LBA5507.
- Banerjee SN, Ring KL, Van Nieuwenhuysen E, Fabbro M, Aghajanian C, Oaknin A, et al. Initial efficacy and safety results from ENGOT-ov60/GOG-3052/RAMP 201: A phase 2 study of avutometinib (VS-6766) ± defactinib in recurrent low-grade serous ovarian cancer (LGSOC). J Clin junio de 2023;41(16_suppl):5515-5515.
- Targeted Oncology [Internet]. 2023 [citado 13 de agosto de 2023]. RAMP 201 Findings Support Use of Avutometinib Plus Defactinib in Recurrent LGSOC. Disponible en: https://www.targetedonc.com/view/ramp-201-findings-support-use-of-avutometinib-plus- defactinib-in-recurrent-lgsoc












