Dra. Veronica Y. Arnao Labajos
Médico Oncólogo
Departamento de Oncología Médica – INEN
En los últimos 30 años ha habido una revolución en el tratamiento del Mieloma múltiple, desde los años 90 en los que sólo contábamos con tratamientos basados en alquilantes y prednisona con tasas de respuesta de alrededor 3%, hasta la era actual en donde tenemos tratamientos basados en inmunoterapia como CAR T CELL o anticuerpos biespecífico incluso para pacientes refractarios.
Entre los paradigmas del mieloma múltiple tenemos el de “intervención temprana”, uno de los nuevos estándares de tratamiento, que consiste en atacar a la enfermedad antes de que se ocasione daño orgánico. En pacientes con diagnóstico de Smoldering mieloma de alto riesgo, que tienen una probabilidad a los 2 años de transformarse a mieloma múltiple (1;2); se recomienda iniciar tratamiento con lenalidomida más dexametasona disminuyendo la progresión a enfermedad sintomática con HR 0.18 y P<0.01 siendo un estándar de tratamiento (3).
Otro paradigma que actualmente ha cambiado en mieloma múltiple es el manejo de los pacientes TCR (Triple refractarios: a inhibidor de proteosoma, inmunomodulares y anticuerpos AntiCD38). Antiguamente no se tenía una opción de tratamiento eficaz para este grupo quedando a libre elección del médico, estos otorgaban un tiempo libre de progresión de 4 meses con una sobrevida global que no sobrepasaba el año, sin embargo, esto cambio con los nuevos tratamientos: BCMA (Antígeno de maduración de la célula B), es dentro de este grupo que se encuentran los CAR T y los anticuerpos biespecíficos, los cuales son una de las nuevas promesas en esta población con pronóstico tan sombrío.
Actualmente se tiene aprobación por FDA para dos CAR T: idecabtagene vicleucel (ide-cel) y ciltacabtagene autoleucel (cilta-cel). Las células T CAR son células T del paciente modificadas genéticamente, por lo que las células T se recolectan y luego se redirigen para atacar el mieloma, se dirigen a BCMA y actualmente están aprobadas por la FDA para pacientes con MM R/R después de ≥4 líneas de terapia previas con buen estatus perfomance, incluido un Inhibidor de proteosoma, un IMiD y un anticuerpo anti-CD38 (4).

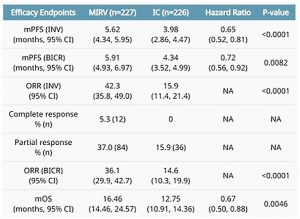
En ASCO 2023, se presentaron protocolos como el CARRTITUDE 4 en donde se comparó CAR T cilta-cel con el tratamiento estándar en recaídas tempranas. Este estudio fase 3, incluyó pacientes que recibieron una a tres líneas de terapia, en adecuado status performance (ECOG 0-2). Los resultados fueron impresionantes, logrando una reducción del 74 % en el riesgo de progresión en comparación con pomalidomida, bortezomib, dexametasona o daratumumab, pomalidomida y dexametasona. La mediana de SLP no fue alcanzada con cilta-cel, mientras que para los pacientes que recibieron con DVd o DPd fue de 11,8 meses, concluyendo que las células T con CAR se obtienen resultados claramente excelentes en este entorno de enfermedad temprana (5).
Por otro lado, el anticuerpo monoclonal biespecífico es un tipo de anticuerpo que se une tanto a la célula de mieloma como a la célula T inmune en el microambiente inmediato para mejorar el efecto de destrucción de las células plasmáticas aberrantes de manera similar. La FDA también aprobó los anticuerpos biespecíficos dirigidos a BCMA, teclistamab y elranatamab, para pacientes con MM R/R después de ≥4 líneas de tratamiento previas (6;7).
Teclistamab es un anticuerpo biespecífico anti-BCMA x CD3. Su aprobación se basó en los resultados del ensayo de fase I/II MajesTEC-1, que evaluó la seguridad y eficacia de Teclistamab en pacientes con MM R/R triple refractarios.
En ASCO 2023, Van de Donk et al. presentaron la actualización de MajesTEC-1, después de una mediana de seguimiento de 23 meses. Un grupo de pacientes de la fase I tuvo un aumento de la dosis IV y SC para encontrar la dosificación aleatoria de la fase II. Luego, en la cohorte de expansión de dosis de fase II, los pacientes recibieron teclistamab a 1,5 mg/kg SC semanalmente, que es la dosis aprobada para uso clínico. Los pacientes que respondieron podrían cambiar a una dosis cada 2 semanas o cada 4 semanas después de 6 meses de tratamiento. El criterio de valoración principal de MajesTEC 1 fue la ORR, después de una mediana de seguimiento de 14,1 meses, se informó una TRO del 63 % con teclistamab (8).
La inmunoterapia en mieloma surge como una opción de tratamiento de rescate en pacientes poli tratados, convirtiéndose en una nueva opción terapéutica que tenemos para este grupo de pacientes, donde no se tenía un estándar y los tratamientos actuales tenían una pobre respuesta.
Bibliografía:
- Rajkumar SV, Kumar S. Multiple myeloma current treatment algorithms. Blood Cancer J 2020;10:94.
- Neben K, Jauch A, Hielscher T, et al. Progression in smoldering myeloma is independently determined by the chromosomal abnormalities del(17p), t(4;14), gain 1q, hyperdiploidy, and tumor load. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2013;31:4325–32.
- Rajkumar SV. Multiple myeloma: 2022 update on diagnosis, risk stratification, and management. Am J Hematol. 2022 Aug;97(8):1086-1107. doi: 10.1002/ajh.26590. Epub 2022 May 23. PMID: 35560063; PMCID: PMC9387011.
- Cho SF, Anderson KC, Tai YT. Targeting B Cell Maturation Antigen (BCMA) in Multiple Myeloma: Potential Uses of BCMA-Based Immunotherapy. Front Immunol. 2018 Aug 10;9:1821. doi: 10.3389/fimmu.2018.01821. PMID: 30147690; PMCID: PMC6095983.
- Dhakal B, Yong K, Harrison SJ, et al: First phase 3 results from CARTITUDE-4: Cilta-cel versus standard of care (PVd or DPd) in lenalidomide-refractory multiple myeloma. 2023 ASCO Annual Meeting. Abstract LBA106. Presented June 5, 2023.
- Martin T, Usmani SZ, Berdeja JG, et al. Ciltacabtagene autoleucel, an anti-B-cell maturation antigen chimeric antigen receptor T-cell therapy, for relapsed/refractory multiple myeloma: CARTITUDE-1 2-year follow-up. J Clin Oncol. 2023;41:1265-1274.
- Rodriguez-Otero P, Ailawadhi S, Arnulf B, et al. Ide-cel or standard regimens in relapsed and refractory multiple myeloma. N Engl J Med. 2023;388:1002-1014.
- Van de Donk NWCJ, Moreau P, Garfall AL, et al. Long-term follow-up from MajesTEC-1 of teclistamab, a B-cell maturation antigen (BCMA) x CD3 bispecific antibody, in patients with relapsed/refractory multiple myeloma (RRMM). Presented at: 2023 American Society of Clinical Oncology Annual Meeting; June 2-6, 2023. Abstract 8011.